Ein Plädoyer für CNG
Jede Treibstoffart hat seine Fan-Gemeinde die mehr oder weniger enthusiastisch mit konstruktiven Beiträgen die (notwendige) Diskussion um die „richtige“ Wahl bzw Ausrichtung der Antriebskonzepte der Zukunft beleben. Gerade in jüngerer Zeit, möglicherweise ausgelöst durch den Popularitätsanstieg von LNG (verflüssigtes Methan), lesen wir nicht selten, daß auch LPG (Autogas) oder GTL (Gas to Liquids) unsere Ziele in der Zukunft absichern ließe, ja, möglicherweise für die Klein- und Großschifffahrt sogar die bessere Wahl sein könnten. Die Schlagzeilen: dass „LNG in der Gesamtbilanz der Treibhausgasemissionen schlechter als Dieselkraftstoff abschneidet“ oder „LPG-Befürworter: LNG bringt keine Vorteile bei Treibhausgasemissionen“ sind es wert, in Bezug auf die Zukunftstauglichkeit auf den Prüfstand gestellt zu werden.
Gerade dann, wenn zwei Optionen LPG oder GTL zur Wahl anstehen, neigen wir verhaltensökonomisch dazu, die vermeintlich bessere der beiden angebotenen Alternativen auszuwählen und nicht zuerst die grundsätzliche Zieltauglichkeit beider derart zu hinterfragen ob es nicht eine noch bessere nicht genannte Alternative geben könnte. Diesem „framing“-Phänomen sollte man bei derart richtungsweisenden Fragestellungen für die Zukunft nicht sofort auf den Leim gehen.
In der Mobilität, anders als bei stationären Anlagen, muß ein Fahrzeug (Auto, LKW, Schiff, Flugzeug, etc) den für die zu bewältigende Strecke erforderlichen Energievorrat mitnehmen, der dann unterwegs aufgebraucht wird. Will man für die Dauer von 10 Stunden 100 kW Leistung abrufen, dann muß man einen Energievorrat von 1000 kWh mitnehmen. Je nach Modalität kann sich aufgrund der Limitationen für Zuladung und Volumen, wobei beide mit der jeweils relevanten Nutzlast konkurrieren, die jeweils vorteilhaftere Art des Energieträgers historisch anders entwickelt haben. D.h. was in der Automobilwelt gut funktioniert muß nicht notwendigerweise auch für die Schifffahrt optimal sein und vice versa. Von besagtem mobilen Energievorrat darf insbesondere unterwegs keine nicht beherrschbare Gefahr ausgehen und sie darf für Besatzung oder Passagiere nicht gesundheitsgefährdend sein. Dieses gilt für die Schifffahrt umso mehr, zumal wir nicht mal gerade am Straßenrand anhalten können, um ein Problem zu lösen oder mal eben nachzutanken.
Aufgrund hoher spezifischer Energie(speicher)dichte in Bezug auf Volumen und Gewicht dominieren Kohlenwasserstoffe (Alkane, früher Parafine genannt) den Energiemarkt für die Mobilität. Viele unterschiedliche Namen wie Methan, LNG, CNG, Ethan, LPG, Propan, Butan, Autogas, Benzin, Super, Petroleum, Kerosin, Diesel, GTL, Heizöl, leichtes Gasöl, MDO, Schweröl u.v.a.m suggerieren grundverschiedene Kraftstoffe. Sie täuschen jedoch darüber hinweg, daß sie alle Geschwister ein- und derselben Familie der Kohlenwasserstoffe (Alkane, Alkene) sind. Da fällt beispielsweise auf, daß angesichts der babylonischen Sprachverwirrung vielen Anwendern ebenfalls nicht klar ist, daß Methan, Erdgas, LNG und CNG in der Tat chemisch exakt denselben Stoff bezeichnen: Methan also CH4.
Insbesondere längerkettige Alkane wie Kerosin, Diesel bis hin zu Gasöl und Schweröl waren historisch in Verbindung mit dem Dieselmotor (hohes Drehmoment bei niedriger Drehzahl) die entscheidenden Erfolgsfaktoren bei dem Ausbau globaler Logistik- und Transportmodalitäten und insbesondere der maritimen Logistik. Wir können uns nur schwer vorstellen, in der Zukunft unsere Mobilitätskonzepte mit seinen bewährten Kraftstoffen anders zu gestalten, um den gestiegenen Anforderungen an Wirtschaftlichkeit und Nachhaltigkeit zu entsprechen.
Letztgenannten Kraftstoffen ist gemein, daß sie in der Regel unter normalen Umgebungsbedingungen flüssig und entsprechend relativ einfach zu handhaben sind (Behälter, Leitungen, Pumpen, Ventile, etc). Durch jahrzehntelangen Umgang mit diesen Stoffen stellte sich eine gewisse Vertrautheit ein, die allerdings über die immanenten Gefahren (z.B.: karzinogen, feuergefährlich, etc) hinwegtäuscht. Hinzu kommt, daß diese Stoffe fossil in großen Mengen vorkommen und daher kostenmäßig attraktiv waren/sind. Dennoch sind diese Vorräte endlich und mit sinkender Ausbeute und zunehmendem Aufwand der Förderung verknappt sich die Versorgung was langfristig zu weiterhin steigenden Preisen führen dürfte.
Daß wir in der Schifffahrt und maritimen Logistik heute über neue Kraftstoff- bzw Energievorrats- und Antriebskonzepte der Zukunft diskutieren liegt nicht nur an den steigenden Preisen fossiler Resourcen und den in verkehrsdichten Regionen nicht mehr tolerierbaren Emissionen der bisherigen Antriebskonzepte, sondern auch oder besonders an der schlichten Erkenntnis, daß wir Technologien entwickeln und einsetzen sollten, die nicht mehr auf fossile bzw nicht erneuerbare Resourcen zurückgreifen.
Nachhaltigkeit sowie geschlossene Stoffkreisläufe auf Basis erneuerbarer Energien ist der Megatrend und ist der ultimative Maßstab für die Zieltauglichkeit der Mobilitätskonzepte der Zukunft.
Um auf die eingangs gestellte Frage nach der Vorteilhaftigkeit von LPG oder GTL eine Antwort finden zu können, ist ein kurzer (populär-wissenschaftlicher) Blick in die Petrochemie unvermeidbar. Erdöl ist eine über Jahrmillionen aus der Verrottung organischer Substanzen entstandene „Ur-Suppe“ unterschiedlichster chemischer Verbindungen, überwiegend Kohlenwasserstoffe in Form von n-Alkanen (mit n=1 bis n>50), iso-Alkanen und Cycloalkanen aber auch aromatischen Verbindungen, Schwefelkohlenstoffen, etc. Jedes Bohrloch bzw Lagerstätte hat aufgrund seiner individuellen Entstehung (meist zurück bis in das Carbon-Zeitalter) einen anderen chemischen „footprint“.
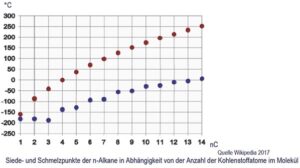
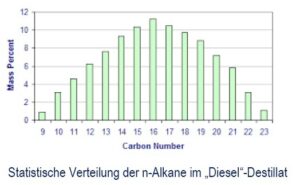
In Raffinerien wird i.d.R. diese Erdöl-Ursuppe mittels Destillation aufgetrennt. In einem Destillator mit verschiedenen Temperaturzonen werden die einzelnen „Destillate“ d.h. entsprechend der Siedetemperaturen (siehe Graphik, rote Punkte) die mit steigendem n kontinuierlich ansteigt, unterschiedliche Alkangruppen abgetrennt. So umfaßt der „Dieselkraftstoff“, das sog. Mitteldestillat von ca 180 °C bis ca 300°C, meist die Alkane von ca.n=10 bis n=22 in unterschiedlicher statistischer Verteilung.
Die jeweiligen Mischungsverhältnisse der einzelnen Alkane in jener Destillatgruppe sind trotz geeigneter Mischung im feedstock unterschiedlich. Da nach Temperaturzonen getrennt wird, sind in den Destillaten natürlich auch – sofern sie nicht vorher herausgefiltert wurden – weiterhin andere Molekülgruppen aus der „Erdöl-Ursuppe“ wie Schwefelkohlenstoffe, Aromatics, etc enthalten, die bei der Verbrennung im Motorbrennraum entsprechende (ggfs infolge der Destillation geringere) Verunreinigungen im Abgas (SOx, NOx,etc) verursachen. Undestillierte fossile Schweröle, wenn sie in Schiffsmotoren sogar direkt verbrannt werden, enthalten eine darüber hinaus unbestimmt größere Menge an jenen weiteren chemischen Verbindungen aus der „Erdöl-Ursuppe“, die zu den bekannten Emissionsproblemen führen.
In der Natur, spätestens seit ihrer bahnbrechenden „Erfindung“ des Chlorophyls vor ca 2-3 Milliarden Jahren, spielt Kohlenstoff eine überragende Rolle in den Energiehaushalten von Pflanzen und Tieren. Nicht zuletzt deshalb nennt man die Kohlenstoff-Chemie auch „organische Chemie“. Eine besondere Eigenschaft des Kohlenstoffes ist, daß es innerhalb eines Moleküls auch eine chemische Verbindung mit sich selbst eingehen kann. Dadurch können sich Kohlenstoffketten unterschiedlichster Längen in Kombination mit anderen Stoffen (H, N, S, etc) bilden.
Gleich nach Sauerstoff, mit dem es eine äußerst „violent reaction“ eingeht (Knallgas), ist Kohlenstoff ein „prefered partner“ für Wasserstoff. Da es in der äußeren Schale des C-Atoms 4 offene Stellen gibt, findet sich z.B. Platz für 4 Wasserstoffatome mit je nur einem Elektron und bildet Methan CH4, das Grundelement der Kohlenwasserstoffe. In der Natur ist es als Erdgas in großen Mengen und hoher Reinheit (>90%) insbesondere bei Lagerstätten, die aus überwiegend pflanzlichen Beständen der Carbon-Zeit stammen, zu finden.
Bei Verbrennung eines CH4 Moleküls, also der chemischen Reaktion mit exakt 4 Sauerstoffatomen, wechseln die Atome unter Abgabe der bisherigen Bindungsenergie die Partner und es entstehen 2 Moleküle Wasser H2O sowie ein Molekül CO2, dem unerwünschten Treibhausgas. Dieses Verhältnis von Wasser (gut) zu CO2 (schlecht) mit 2 : 1 ist somit stöchiometrisch sowie aus dem Massenerhaltungsgesetz bedingt.
Während Methan im Erdgas als einfachstes Alkan mit n=1 streng genommen noch keine „Kette“ darstellt, kommen in der „Erdöl-Ursuppe“ hingegen längere CnH2n+2-Ketten vor. Ethan C2H6 besteht aus 2 Teilmolekülen CH3 wobei die beiden C-Atome sich jeweils mit je einer Verbindung halten und damit die erste Kette bilden. Somit stehen bei stöchiometrischer Verbrennung von Ethan 3 Wassermolekülen 2 CO2-Moleküle gegenüber, einem Verhältnis von „gut zu schlecht“ von nur noch 1,5 :1
Bei Propan, dem nächsten Alkan C3H8 und einem der Hauptbestandsanteile von LPG, ist zwischen den beiden „Endmolekülen“ CH3 à la Ethan ein erstes (regelmäßiges) Kettenglied CH2 eingefügt. Da je eine Kohlenstoffbindung links und rechts erforderlich ist, bleibt am C-Atom dieses Kettengliedes nur noch Platz für 2 Wasserstoffatome. Bei stöchiometrischer Verbrennung ist das Verhältnis bezogen auf das Treibhausgas CO2 nur noch 4 : 3 also 1,333 : 1 weil das eingefügte CH2 Molekül für sich nur 1 : 1 ist. Jedes weitere Alkan hat dann ein jeweils weiteres Kettenglied CH2 eingefügt. Das bedeutet, daß für jedes längere Alkan, z.B. ab Butan – dem zweiten Hauptbestandanteil von LPG – und fortfolgende sich die Wasserdampf- zu CO2-Bilanz asymptotisch dem Verhältnis 1:1 nähert und so gesehen 50% schlechter als Methan wird.
Dabei wird auch deutlich, daß bei steigender Anzahl der C Atome (Länge der Kette) ein gegenüber Methan überproportional steigender Vorrat von Sauerstoffatomen bereitgestellt werden muß, um die vollständige Verbrennung sicherzustellen. Da unsere Atmosphäre jedoch keine Sauerstoff-Atmosphäre sondern eher eine Stickstoffatmosphäre ist (80% N2 zu ca 18% O2) werden im Brennraum bei steigendem Bedarf an Sauerstoffatomen überproportional (ca 4,5-fach) mehr Stickstoffatome geladen als es zB beim Verbrennen von Methan erforderlich wäre. Bei schwerem Gasöl oder Schweröl muß meist sogar ein Turbolader helfen, um die notwendigen überproportional vielen Sauerstoffatome in dem Brennraum zu pressen. Sind es stöchiometrisch nicht genug oder die Verbrennung dauert zu lange während der Kolben sich bereits nach unten bewegt und dekomprimiert, so bleiben unverbrannte C-Atome übrig, die den Ruß bzw Feinstaub, particle matter bilden (Markenzeichen: schwarze Rauchfahne aus dem Schornstein).
Bei diesem stöchiometrischen Überschuss an Sauerstoffatomen, den hohen Temperaturen im Brennraum sowie dem damit gekoppelten 4,5fachen Stickstoffüberschuss wird die Entstehung von NO- sowie NO2 Verbindungen ebenfalls gefördert, den zunehmend wegen Gesundheitsgefährdung im Fokus stehenden Stickoxiden NOx‘n.
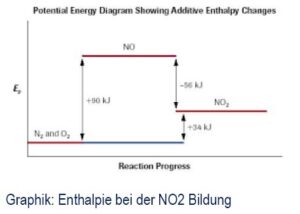
Die Grapik illustriert den Ablauf sowie die Enthalpie bei der Bildung von NOx. Wenn im Brennraum hoher Druck und große Hitze vorliegen aber gerade mal kein Wasserstoff- oder Kohlenstoffatom in unmittelbarer Nähe zur Verfügung steht, dann fusionieren auch schon mal ein im Überfluß vorhandenes Stickstoff- und ein Sauerstoffatom zu NO (entziehen dem Brennraum 90 kJ/Mol an Bindungsenergie). Im zweiten Schritt verbrennt/oxidiert dieses NO Molekül dann unter Freisetzung von 56 kJ/Mol zu NO2, dem schädlichen NOx. In Summe bleibt ein Energieverlust von 34 kJ durch die Bildung von NOx.
Stickstoff ist für die Verbrennung von Kraftstoff im Brennraum nicht erforderlich. Es ist sogar nachteilig wie die Stickoxid NOx Bildung bei Sauer- und Stickstoffüberschuß gerade gezeigt hat. Außerdem tragen diese, nicht zur Leistungsentfaltung im Brennraum beitragenden Gase, thermische Energie aus dem Brennraum in den Auspuff und verschlechtern somit die Leistungsbilanz. Salopp gesagt wird der Brennraum zum Durchlauferhitzer für nicht benötigte Gase.
Wir stellen uns meist vor, daß es „den Diesel-Kraftstoff“ als fest definiertes Alkan-Molekül wie nachstehend im Bild das Molekül C14H30 als bilderbuchartige lineare Kette gibt.
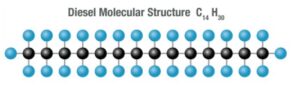
Zwei Phänomene stehen dem entgegen. Erstens ist „Diesel“ ein stochastisch zusammengesetztes Gemisch aus einer Reihe von n-Alkanen von n=10 bis n=20 (siehe Graphik: statistische Verteilung) mit hoher Streubreite in der Verteilung. Zweitens, nachdem Kohlenstoff mit sich selbst Verbindungen eingehen kann und die Bindungsenergie innerhalb der Molekülkette immer schwächer je länger die Kette wird, gibt es viele „Isomere“, also Figuren / Kombinationen von n-mal CHx Molekülen (Teilketten als Bäume bis sphärische Teilkugeln) die in Summe genau der Formel CnH2n+2 genügen.
Beide Phänomene wirken sich sehr auf den Verbrennungsvorgang aus. Die schwächer werdende Bindungsenergie längerer Alkane erlaubt die bekannte Selbstzündung des Dieselkraftstoffes bei hoher Kompression. Die stochastisch verschiedene n-Zahl aus dem Diesel-Mix erschwert jedoch die Stöchiometrie, also die Zuführung der exakten Anzahl von Sauerstoffatomen in jedem Verbrennungstakt. Damit kann es während der Verbrennung zu lokaler Unterversorgung (Ruß, Feinstaub) bzw der Überversorgung (incl Überversorgung mit Stickstoffatomen: NOx) geben.
Je größer n wird, umso mehr Sauerstoffatome müssen cet.par. (ceteris paribus = alles andere bleibt ansonsten gleich) für die chemische Reaktion an das n-Alkan in die unmittelbare physische Nähe des Moleküls gebracht werden. Je sphärischer, kugelförmiger die Figur wird umso geringer ist die Oberfläche des Moleküls im Verhältnis zum Innenraumvolumen und damit die Chance, daß während der zeitlich endlich ablaufenden chemischen Reaktion auch alle CH2 Teilstränge der Isomere tiefer im Inneren ausreichend mit Sauerstoffatomen versorgt werden. Die Verteilung der Figuren der Isomere ist jedoch stochastisch und nicht planbar. Allein bei dem gezeigten C14H30 Alkan gibt es schon 1858 Isomere. Die Zahl der Kombinationen steigt mit zunehmendem n exponentiell an. Bei C20H42 sind es dann bereits 366319 Isomere.
Ab n=3 (Propan C3H8) kann es sogar ringförmige Zyklo-Alkane geben, d.h. statt 2 Wasserstoffatome anzudocken, können sich das Anfangs-C- mit Schluß-C Atom zusammenschließen und derart einen Ring bilden bzw ein Dreieck im Falle des Propans. Damit ist nur noch Platz für 6 (statt 8) Wasserstoffatome und bildet das Cyclo-Propan C3H6 das als TriMethylen bekannt ist. In der Vergangenheit wurde es z.B. in 15-30%iger Mischung mit Sauerstoff als Narkosemittel verwendet. Nicht nur daß energetisch gesehen 2 Wasserstoffatome bei der Energiefreisetzung fehlen, hat es beeinträchtigende physiologische Wirkung. Das führte beispielsweise dazu, daß Propan in der Vergangenheit eine zeitlang als gefährlich eingestuft wurde. Ebenso gibt es Cyclo Butane usw.
Während solitäre Methan-Moleküle als Gas im Brennraum optimal und stöchiometrisch ausgewogen (Lambda Sonde) mit Sauerstoffatomen gemischt werden können, werden bei Normaltemperatur flüssige, längerkettige Alkane, wie z.B. „Diesel-Kraftstoffe“ daher nicht als Gas sondern flüssig durch feine Düsen gepreßt und somit als Aerosole in den Brennraum gemischt. Wie oben bereits angesprochen sind nun nicht nur die isomerischen Moleküle an sich sondern obendrein noch innerhalb größerer Molekül-Klumpen des Aerosols zusammengeklumpt, in der Verbrennung örtlich und zeitlich erheblich stärker behindert als gasförmige Brennstoffe. Unvollständige Verbrennung der Kohlenstoffanteile trotz generell hohem Sauerstoffüberschuß führt zwangsläufig zur Bildung von Kohlenmonoxid sowie Russ bzw Partikel-Emission/Feinstaub als auch NOx.
Propan und Butan, die beiden Hauptbestandteile des LPG, fallen bei der Destillation von (fossilem) Erdöl an. Bei Standardtemperatur sind sie gerade schon gasförmig (siehe Graphik: Siedetemperaturen von n-Alkanen) und werden unter Druck verflüssigt, um sie dann als LPG in Druckbehältern besser transportieren, speichern und vermarkten zu können. LPG wird nicht selten aus Unkenntnis (sowie irreführender Bezeichnung als „Autogas“) mit Erdgas, also Methan (CNG, LNG) verwechselt. Unschwer ist aus der Molekülstruktur zu erkennen, daß LPG Moleküle aus 3 bzw 4 C-Atomen mit je 8 oder 10 H-Atomen schwerer als „Luft-Moleküle“ (N2 also nur 2 Stickstoffatome) sind. Propane und Butane sinken also bei Freisetzung nach unten und sammeln sich in „Gas-Pfützen“ während Methan leichter als Luft ist und aufsteigt.
Dieser Unterschied wiegt bei der Eignung für die Schifffahrt schwer. Gemäß Murphy’s Law (if anything can go wrong, it will) können in der Installation im Schiffsrumpf Undichtigkeiten nie ganz ausgeschlossen werden. Somit würden sich LPG Gase im tiefsten Teil des Rumpfes, z.B. der Bilge, sammeln, dort möglicherweise verpuffen und derart Schäden an Mensch und Maschine verursachen, während Methan (aus LNG oder CNG) nach oben steigen würde und bei entsprechender konstruktiver Vorkehr einfach ventiliert bzw eingefangen werden kann. Dieses Fakt war bei Entscheidung der International Maritime Organization (IMO), Methan (aus LNG) als Treibstoff zuzulassen, ebenfalls ein tragendes Argument bei der historischen Abkehr von der totalen Abstinenz von gaseous fuels.
LPG variiert in seinem prozentualen Mengenverhältnis im Jahresverlauf recht deutlich. Im Winter-LPG sind deutlich mehr Propan Anteile als im Sommer (wg Siedepunkt von Butan um Null Grad). Obwohl anders als bei Methan kann mit LPG kein Betrieb mit idealem stöchiometrischen Gleichgewicht von Alkan zu Sauerstoff erreicht werden. Allerdings ist bei erforderlichem Sauerstoffüberschuß und gasförmigem Propan bzw Butan nicht mit Kohlenmonoxyd und Russpartikel zu rechnen. Deshalb sind Antriebe, z.B. Gabelstapler sowohl mit Methan als auch mit Propan/Butan Antriebssystemen in belüfteten Räumen zugelassen.
Aus dem Energieerhaltungssatz folgt, daß die Summe der zugeführten Energie gleich der Summe der abgeführten Energie sein muß. Die Enthalpie-Betrachtung aus der Thermochemie liefert Hinweise über die energetischen Zusammenhänge bei der Verbrennung der zur Diskussion stehenden Stoffe.

Die Graphik zeigt am Beispiel der Verbrennung eines Propan-Moleküls, daß mit Zufuhr einer geringen Energiemenge (Zündenergie) von ca 34,6 kJ je C-Atom die Bindungsenergie innerhalb eines Propan-Moleküls aufgehoben wird. Derart vereinzelt greifen sich die nun freien C- und H-Atome „ihre“ Sauerstoffatome in der unmittelbaren Nähe. Bei der Bildung (Verbrennung) von 3 C-Atomen zu CO2 werden jeweils 393,3 kJ als Wärme frei (Summe = 1181 kJ) und bei der Verbrennung von 8 Wasserstoffatomen zu 4 Wasser-Molekülen werden nochmals 1143 kJ als Wärme frei, d.h. jede Wasserstoffdoublette setzt 285,6 kJ frei.
Bei längerkettigen Alkanen in Kerosin, Dieselkraftstoff, Heizöl, Schweröl etc steigt die Standard Enthalpy of Combustion jedoch nur noch um 653 – 658 kJ je weiterem CH2-Glied. Da die CO2 Emission eine kritische Variable in unserem Entscheidungsproblem ist, stellt sich bei relativer Betrachtung des Energiepotentials je anfallendem CO2 Molekül im Abgas, Methan cet.par. als effizientester Energiespeicher dar:
Methan: 891 kJ/CO2
Ethane: 780 kJ/CO2
Propane: 740 kJ/CO2
Butane: 720 kJ/CO2
Pentane: 702
Hexane: 693
Heptane: 688
Octane: 684
Diese Reihe läßt sich fortsetzen und nähert sich dann asymptotisch dem Grenzwert von 653-658 kJ/CO2. Bei cet.par. gleicher enthalpischer Energiefreisetzung leitet sich aus der thermochemischen Analyse ab, daß Methan (aus LNG, CNG oder Pipeline) einen systemischen CO2 Vorteil von 17% gegenüber Propan, 19% gegenüber Butan und 26% gegenüber „Diesel“ und allen weiteren längerkettigen Alkanen hat.
Aktuell wird GTL (gas to liquids) als innovativer und sauberer Dieselkraftstoff-Ersatz z.B. für die Schifffahrt angepriesen. Dahinter steht das bekannte und nicht mehr ganz so neue Fischer-Tropsch-Verfahren, mit dem z.B. wegen des kriegsbedingten Embargos in den 30er und 40er Jahren in Deutschland Dieselkraftstoff aus Syngas synthetisch hergestellt wurde. Dieses Verfahren wurde inzwischen erheblich verbessert und jede große Mineralölfirma hat heute ihr eigenes Verfahren und auch entsprechende Anlagen. Meist werden dort u.a. „stranded gas“, also Gasrückstände oder geografisch isolierte Gasvorräte zu höherwertigem Kraftstoff à la Dieselkraftstoff, dem GTL, verarbeitet, die sich dann (weil flüssig und höherem Marktpreis) besser transportieren und somit in die üblichen Absatzkanäle einbringen lassen.
Aufgrund der Synthese sind die natürlichen Verunreinigungen des Feedstocks aus der Lagerstätte, insbesondere Schwefel- und andere Aromaticsverbindungen, bei GTL auf ein Minimum reduziert und die Abgase aus GTL daher ohne SOx und ggfs Aromatics Anteile entsprechend reiner. Allerdings bleiben die systemischen Nachteile der längerkettigen Alkane des GTL‘s analog zum Dieselkraftstoff in Bezug auf CO2, NOx (aus Sauerstoff- und Stickstoffüberschuß) und der spezifischen Energieausbeute gegenüber Methan wie oben diskutiert. Gerade in diesem Zusammenhang stellt sich allerdings die Frage, weshalb man bereits vorliegendes hochwertiges Methan zu GTL, also längerkettigen Alkanen mit deren erörterten spezifischen Nachteilen, verarbeiten bzw verschlechtern sollte.
Die oben geführte enthalpische Betrachtung aus der Thermochemie macht deutlich, daß bei steigender Anzahl der C Atome (Länge der Kette) wie sie bei Diesel-Kraftstoffen der Fall ist, ein gegenüber Methan überproportional steigender Vorrat von Sauerstoffatomen bereitgestellt werden muß, um die vollständige Verbrennung zu gewährleisten. Damit wird die Bildung von NOx gefördert und die CO2 Bilanz immer nachteiliger sowie die Energieausbeute pro CO2 erzeugt cet.par. schlechter je länger die Alkan Kette wird.
Die derzeit in den Medien und Öffentlichkeit diskutierten Nachteile des „Diesels“ sind daher Nachteile des Dieselkraftstoffes und nicht notwendigerweise Nachteile Rudolf Diesel’s Motor-Prinzip eines Selbstzünders.
Die EU hatte bereits vor Jahren in der Norm für Dieselkraftstoffe nachgebessert und dabei i.w. die längerkettigen (rußenden) Alkane abgeschnitten. Aber das war, wie wir sehen, noch nicht genug. Die Frage, „wieviel genug wäre denn genug“, muß zunächst offen bleiben.
Die heute dominierende Quelle für Methan ist (fossiles) Erdgas, das via Pipelines und Verdichterstationen von der Lagerstätte bis zum Verbraucher gebracht wird. Da jedes Erdgasfeld seine individuelle petrochemische Entwicklungsgeschichte hat, gibt es auch im Pipeline-Erdgas durchaus Verunreinigungen, die bei Verbrennung unerwünschte Emissionen verursachen. Man denke z.B. an die „Sauergas-Felder“ in Lingen, die einen höheren Schwefelanteil haben, der dann herausgefiltert wird.
Riesige Erdgasfelder ohne Pipelineanschluß bzw ohne geografisch nahegelegene Großverbraucher, insbesondere in fernen Insellagen, werden heute via LNG-Technik erschlossen. Erdgas wird unter minus 162 Grad also unter seinen Siedepunkt heruntergekühlt und verflüssigt sich dabei (LNG: liquefied natural gas). Dadurch kollabiert das Volumen auf ein 600stel des gasförmigen Volumens und kann derart kompakt in Thermoskannen-gleichen Behältern transportkostengünstig über die Weltmeere transportiert werden. Schätzungen lassen erkennen, daß energetisch gesehen die fossilen Vorräte an Erdgas die bekannten Erdölvorräte um ein Vielfaches übersteigen. Die LNG-Technik für die großvolumige Vorratshaltung und Transport von Methan steht somit erst am Anfang und hat also eine noch sehr lange „runway“ für Innovationssprünge vor sich.
Da Förderung, Verflüssigung und Transport von Erdgas dadurch recht kostengünstig wurde, liegt der Weltmarktpreis pro kWh weit unter dem der Erdölprodukte. Erdgas wird wegen seiner globalen Mobilität per LNG sowie der Pluralität von globalen Anbietern und Nachfragern inzwischen an der NYMEX in New York gehandelt und bildet derart einen Weltmarktpreis für Methan. Pipeline-Erdgas hingegen unterliegt dem klassischen Monopolpreis-Kräftespiel (ein Anbieter, der das Erdgas in die Pipeline füllt (oder auch nicht) und viele abhängige Abnehmer ohne Alternative außer Abstinenz) und weist daher ein weit höheres Preisniveau auf wie z.B. in der BRD zu beobachten ist.
Da (alle) Gas-Moleküle einen typischen Siedepunkt haben, hat z.B. Fa Linde sich dieses Phänomen zu eigen gemacht, um industriell, hochreine Gase (Stickstoff, Sauerstoff, Helium, etc) per Tiefkühltechnik z.B. aus der Luft herauszutrennen. Entsprechend werden bei dem Herunterkühlen von Erdgas auf minus 162 Grad ebenfalls Verunreinigungen herausgefiltert, so daß man davon ausgehen kann, daß das Methan aus dem LNG-Prozess hochrein ist.
Wie vorstehend ausgeführt, ist der Dieselkraftstoff ein wichtiger Faktor in der Emissionsproblematik des Dieselantriebskonzeptes. Nicht zuletzt weil Robert Bosch seine bahnbrechende Erfindung der (zuverlässigen) elektrischen Zündung für Gasmotoren (Otto-Prinzip) erst noch machen mußte, setzte Rudolf Diesel seinerzeit auf die Selbstzündung der längerkettigen Parafine bei hohen Kompressionsdrücken (und thermodynamischer Erhitzung). Natürlich können auch kurzkettige Alkane bis einschließlich Methan zur Selbstzündung gebracht werden, nur würden die Kompressionsdrücke jenseits der wirtschaftlichen Nutzbarkeit sein.
Westport Innovations Inc aus Vancouver (spin off der University of B.C.) hat aus der universitären Forschung stammende Technologien patentiert und kommerzialisiert, bei denen Methan der Hauptenergieträger in stöchiometrischer Mischung mit Sauerstoff in einem modifizierten Cummins-Dieselmotor ist, dabei die Selbstzündung und damit die für Selbstzünder typische Drehmoment-Drehzahl-Charakteristik des Dieselmotors beibehält. Wie oben ausgeführt sind die Emissionswerte – abgesehen von der systemisch mit Methan gekoppelten CO2 Freisetzung – „near zero“ also unterhalb der derzeit strengsten Grenzwerte bzgl Methanschlupf, SOx, NOx, Ruß und Feinstaub. Das belegt eindrucksvoll, daß der Dieselmotor als solcher ein wenig zu Unrecht in Verruf geraten und der Dieselkraftstoff eigentlich der Übeltäter ist.
Wie eingangs postuliert, darf bei aller akribischer Beschäftigung mit den Vergleichsparametern und dem Herausarbeiten eines Klassenprimus, nicht aus dem Auge gelassen werden, daß alle oben analysierten Alkan-basierten Kraftststoffe heute aus fossilen, nicht erneuerbaren Energieträgern bestehen und damit nicht mit dem eingangs postulierten Megatrend der Nachhaltigkeit konform sind. Dennoch sind die gewonnenen Erkenntnisse geradezu unverzichtbar für die Gestaltung eines Migrationspfades in die Zukunft.
Erdgas, also Methan, hat sich über Jahrzehnte als sauberer, zuverlässiger und vielseitiger Brennstoff in privaten Haushalten und der Wirtschaft erwiesen. Meine Mutter hat damit gekocht, geheizt, etc ohne uns Kinder dabei in die Luft zu sprengen oder von Hazmat-Teams in zweijährigem Rhythmus in der richtigen Handhabung geschult und zertifiziert zu werden. Folgerichtig wurde das Erdgas-Transport- und Verteilnetz innerhalb der BRD sehr weitflächig ausgebaut und erreicht heute nahezu jeden Winkel der Republik. Übrigens: LNG ist chemisch exakt jenes Erdgas, also eigentlich nichts Ungewöhnliches außer daß es kalt ist.
Eine Erdgas-Pipeline ist ein Gefäß gefüllt mit Erdgas, also ein klassischer Erdgas-Speicher. Kenner schätzen, daß der Erdgasbestand in dem Verteilnetz in der BRD eine Reichweite von ca 6 Monaten haben dürfte. Ein mächtiger Speicher also, der bereits existiert. Auch gibt es bereits ca 900 CNG Tankstellen für Kraftfahrzeuge, die aus dem Erdgasnetz per Kompressor kostengünstig und umweltfreundlicher als Benzin, Diesel oder LPG betankt werden (siehe oben).
1912 wurde der französische Chemiker Paul Sabatier für seine Arbeiten der „Hydrierung organischer Substanzen unter Mitwirkung von Metallpartikel“ (Katalysatoren) mit dem Nobelpreis für Chemie ausgezeichnet. Dabei gelang es ihm u.a. mithilfe eines einfachen Katalysators CO2 in Methan CH4 unter Einbringung von Wasserstoff (Hydrierung) zu wandeln. Sabatier hat exakt den Umkehrprozess der oben beschriebenen Verbrennung von Methan zu CO2 beschrieben. Der Wasserstoff zur Hydrierung kann heute aus (erneuerbarem) Wind- und Solarstrom mittels Elektrolyse gewonnen werden. Welche Weitsicht des Nobelpreis-Kommittees! Als hätte man damals schon gewußt, daß dieser Schritt eines Tages der „missing link“ zur CO2-neutralen und damit nachhaltigen Mobilität sein würde.
Das somit aus (recyceltem) CO2 und erneuerbarer Energie hergestellte Methan ist hochrein und könnte in nahezu unbegrenzter Menge in das bestehende Erdgas-Pipelinenetz eingespeist, derart zwischengespeichert und an jeder beliebigen Stelle zu einem anderen Zeitpunkt entnommen werden. Derartige Anlagen gibt es auch in großtechnischen Dimensionen bereits. Mit zuwachsender Methanisierungskapazität und weiterem Ausbau der Wind- und Solarkapazität könnte stetig das fossile Erdgas verdrängt, substituiert und letztendlich abgelöst werden bis eines Tages überhaupt kein fossiles Erdgas (oder auch kein fossiler Dieselkraftstoff, oder auch kein fossiles Benzin, oder..) mehr gebraucht wird. Bis dahin ist fossiles Methan der fall-back, das Sicherheitsnetz. Die Transport-, Speicher- und Verteilinfrastruktur per Erdgasnetz existiert bereits, die Technologien sind bekannt und auch in Großanlagen realisiert. Anders als z.B. für eine noch zu erstellende dedizierte Wasserstoff-Infrastruktur oder großflächige LNG-Infrastruktur oder die umstrittene Hochspannungs-Trasse Nord-Süd … oder… gibt es für Methan eigentlich kein Henne-Ei-Problem mehr. Wir könnten morgen beginnen, nachhaltige CO2-neutrale Mobilität umzusetzen.
Derart ließe sich mittels Methan der Stoffkreislauf entsprechend des eingangs geforderten Megatrends CO2 neutral schließen. LNG, also verflüssigtes Methan, unterstützt den Brückenschlag zur Zukunft, den uns abgesehen von deren ohnehin schon individuellen Nachteilen wie oben herausgearbeitet, weder LPG noch GTL bieten können. Also, weshalb verzetteln?
Natürlich kann man sich vorstellen, auch eines Tages derart wie oben beschriebenes, aus CO2 als Rohstoff sowie mittels Wind- und Solarenergie hergestelltes „grünes“, CO2-neutrales Methan seinerseits zu LNG zu verflüssigen und auch in der Großschifffahrt letztendlich vollständig unabhängig von fossilem Treibstoff zu werden.
Weshalb wollte man es zu LPG oder GTL wandeln wenn man es wesentlich vorteilhafter schon als Methan nutzen kann?




